Il collagene è la proteina principale dei tessuti connettivi degli animali. Ultimamente, tra marketing e speculazione, abbiamo sentito questa parola risuonare in molti prodotti di cosmetica e non solo. Ma cosa stiamo assumendo e funzioneranno davvero questi prodotti? Cerchiamo di approfondire l’argomento.
IN BREVE
Indice
LA SUPERFAMIGLIA DEL COLLAGENE
Contrariamente a quanto si possa pensare, il collagene non è un’unica e sola proteina, ma costituisce una “superfamiglia” di proteine. In particolare, la superfamiglia dei collageni costituisce il gruppo più ampio di proteine extracellulari dei mammiferi ed ogni membro ha funzioni differenti. Grossolanamente però, possiamo dire che i collageni costituiscono la base della matrice extracellulare, all’interno della quale si organizzano le cellule e i tessuti.
Tutti i suoi membri sono accomunati dal possedere un dominio a tripla elica formato da tre catene polipeptidiche, che contengono al loro interno una ripetizione amminoacidica Gly-Xaa-Yaa (Gly = Glicina, Xaa = prolina e Yaa = idrossiprolina). È proprio la presenza di questa ripetizione; soprattutto quella dell’amminoacido Gly, che grazie alle sue ridotte dimensioni non crea ingombro sterico e consente alle tre catene polipeptidiche di avvolgersi e formare una tripla elica.
Le proteine del collagene sono sintetizzate dalla maggior parte delle componenti cellulari del tessuto connettivo, come ad es. fibroblasti, condrociti, osteoblasti e periciti. Esistono 28 tipi di collageni sensu stricto. Queste si distinguono dalle proteine che contengono un dominio simil-collagene, come la proteina del complemento C1q oppure la proteina C legante il mannosio. I collageni possono essere divisi a seconda della struttura sovramolecolare in:
- Fibrillari
- Formanti reti
- Con tripla elica interrotta associati a fibrille
- Formanti filamenti a collana di perle
- Formanti fibrille di ancoraggio
Le proprietà specifiche e caratteristiche di ogni tipo di collagene sono dovute soprattutto a differenze in:
- Numero e lunghezza dei segmenti a tripla elica (detti segmenti collagenosi)
- Segmenti che affiancano o interrompono i segmenti a tripla elica e che si ripiegano in altri tipi di strutture 3D (introducono flessibilità)
- Modificazioni covalenti delle catene a (es. idrossilazione, glicosilazione, ossidazione, formazione di legami incrociati).
Quindi, come si può facilmente evincere, ogni tipo di collagene ha il suo ruolo. Ad esempio, il collagene di tipo I (il collagene fibrillare più abbondante nell’organismo) costituisce la maggiore proteina strutturale di ossa, denti e vari altri tessuti. Il collagene di tipo V è presente nella cornea in formazioni di fibrille ortogonali. Nella cartilagine invece, abbiamo fibrille sottili di collagene di tipo II, XI e IX.
SINTESI E ANALISI STRUTTURALE DEL COLLAGENE
I collageni possono essere formati da più catene polipeptidiche differenti provenienti da diversi geni (in totale ne sono stati trovati 45); ad es. il collagene di tipo 1 nell’uomo è formato da una catena a1 e due catene a2, che sono rispettivamente codificate dai geni COL1A1 e COL1A2.
La sintesi
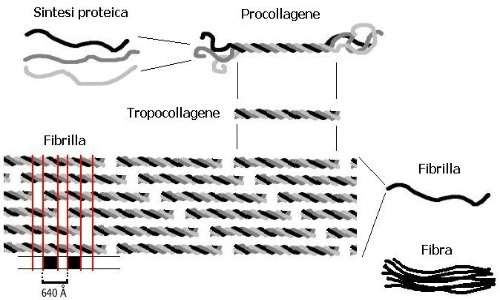
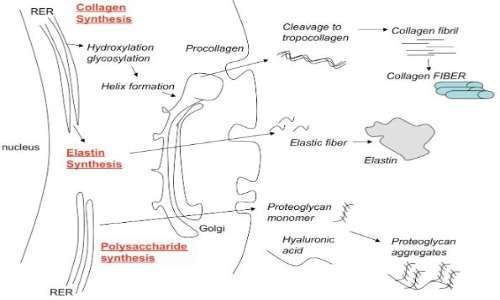
Il collagene di tipo 1 viene sintetizzato dai ribosomi nel reticolo endoplasmatico rugoso prima come pro-collagene, forma caratterizzata dalla presenza dei propeptidi N e C che fiancheggiano la regione triploelicoidale tramite due telopeptidi corti (telopeptide N e telopeptide C). Successivamente, alcune proteasi rimuoveranno questi propeptidi affinché si formino le fibrille mature di collagene. La presenza iniziale di questi propeptidi impedisce l’assemblaggio potenzialmente catastrofico di fibrille all’interno della cellula. Inoltre, ciò è ulteriormente scongiurato dal fatto che la lisil-ossidasi, che catalizza la formazione di aldeidi reattive per la formazione di legami crociati, è un enzima extracellulare.
In particolare il telopeptide C contiene una sequenza di 15 amminoacidi nota come regione di riconoscimento della catena, indispensabile per il riconoscimento, l’identificazione e la stechiometria della stessa proteina. Inoltre, vi sono qui dei residui di cisteina che, formando ponti di solfuro intra- o inter-molecolari, contribuiscono alla stabilizzazione.
La struttura
Le catene peptidiche, che come già detto sono caratterizzate dalla ripetizione amminoacidica Gly-Xaa-Yaa, vengono trasportate nel lume del reticolo endoplasmatico ruvido (RER). Successivamente, la catena di procollagene subisce una serie di reazioni di elaborazione. In primo luogo, come per altre proteine secrete, la glicosilazione del procollagene si verifica nel complesso ER e nel complesso di Golgi, dove residui di galattosio e glucosio vengono aggiunti ai residui idrossilici. Inoltre, alcuni enzimi aggiungono oligosaccaridi a certi residui di asparagina nel propeptide C-terminale.
Nei collageni fibrillari tre catene polipeptidiche vanno a formare il dominio Col-triploelicoidale con brevi estensioni telopeptidiche non elicoidali: questa unità è chiamata tropocollagene. Molti di questi tropocollageni si riuniscono per formare una fibra (dai 50-200 nm), in cui ciascun monomero a tripla elica è sfalsato rispetto ai monomeri adiacenti per un numero intero di periodi D (67 nm o 234 residui nei moderni collageni) e la lunghezza dell’elica corrisponde a circa 4.3 periodi D.
Le fibre sono stabilizzate da legami crociati covalenti (intra- e inter-molecolari) tra idrossilisina e lisina nei telopeptidi (nel collagene di tipo uno 9 N e 16 C in a1 e 5 N in a2) e ad entrambe le estremità del dominio triploelicoidale (nelle posizioni 87 e 930 in a1 e 87 e 933 in a2).
STUDIO E RICERCA SUL COLLAGENE
Negli ultimi anni il collagene è stato studiato e caratterizzato (anche a livello genetico) in zebrafish per studiare patologie scheletriche. In particolare, ci si è concentrati sul collagene di tipo I, in relazione alla malattia nota come osteogenesi imperfetta. Questa malattia genetica, causata dalle mutazioni dei geni COL1A1 e 2, porta ad avere molecole di collagene che non riescono a formare la tipica conformazione a tripla elica. Ciò porta a problemi a carico dello scheletro, delle articolazioni, degli occhi, delle orecchie, della cute e dei denti.
In un diverso ambito, ma sempre “in ambiente clinico”, sono state fatte numerose pubblicazioni scientifiche su tilapia per quanto riguarda l’utilizzo di peptidi di collagene marino nel trattamento di ustioni e/o ferite. Il collagene usato nell’industria cosmetica/medica di solito è di derivazione animale. Per quanto riguarda la produzione di collageni a scopo terapeutico, ad esempio, è ideale l’uso di pesci di taglia grossa, i cui resti (dell’industria ittica) non vengono utilizzati. In generale, nei pesci marini pelle ossa e squame rappresentano il 30% degli scarti di lavorazione che pertanto potrebbero trasformarsi in materia prima da cui prelevare collagene. Per questa ragione è stata scelta la tilapia, un pesce molto resistente con costi di allevamento bassissimi. In America, la tilapia è tra i 10 pesci più consumati (soltanto nel 2010 negli USA ha raggiunto vendite per circa 215.000 tonnellate).

COLLAGENE IDROLIZZATO: COSA VUOL DIRE?
Recentemente siamo bombardati di una serie di prodotti al collagene: integratori, creme, acqua arricchita, pastiglie… Tutto a base di collagene o collagene idrolizzato. Ma cosa vuol dire? Il termine idrolizzato indica come la proteina di partenza, nel nostro caso il collagene, sia frammentata in piccoli pezzetti formati da diversi amminoacidi. Ciò significa che, essenzialmente, di collagene vero e proprio nel prodotto comprato, non ce n’è! Inoltre, è importante ricordare come, anche nel caso in cui ci fosse nella pastiglia (o nell’integratore di qual si voglia forma), il collagene verrebbe prima o poi “spezzettato” dei nostri stessi enzimi. Questo semplice concetto quindi rende dubbia la funzionalità di questi prodotti assunti per via orale.
Anche per quanto riguarda le creme, esse seppur arrochite di collagene, la proteina stessa è impossibilitata nel raggiungere gli strati profondi e vascolarizzati della pelle ed essere assorbita. In questo caso, lo strato corneo (strati di cellule dell’epidermide morte) ne ostacola (e non poco) il passaggio. Tra una perplessità e l’altra, proviamo ad esaminare alcuni esperimenti e ricavare informazioni dei possibili utilizzi del collagene e del loro livello di efficacia.
Il collagene marino nella cura delle ustioni
Diversi studi (tra cui quello riportato nelle referenze del professore di chimica cinese Zhang Hu) hanno come obiettivo di testare l’efficacia dei peptidi di collagene marino (MCP) preparati mediante idrolisi, per la guarigione di ustioni. In questo caso la sperimentazione ha utilizzato come modello il coniglio, di cui alcuni individui venivano trattati con la soluzione di MCP ed altri con un placebo. I MCP sono stati preparati dalla pelle della tilapia mediante idrolisi enzimatica (proteasi neutra e papaina). Inoltre è stato verificato come questi idrolizzati erano composti da polipeptidi con pesi molecolari non superiore a 5 kDa. Ciò sta ad indicare come l’idrolizzato non possa sostituire ed agire come un vero e proprio “rimpiazzo” del collagene perso.
Nonostante ciò, gli esperimenti di guarigione delle scottature profonde nei conigli hanno indicato che il trattamento con gli MCP velocizzava il processo di cura delle ustioni. Purtroppo però l’esperimento si è fermato qui, senza andare a fondo e trovare la spiegazione nei meccanismi che avrebbero portato a questo miglioramento.
Assunzione orale di collagene: integratori e acque al collagene idrolizzato
Ultimamente, negli scaffali di supermercati e non solo, stanno aumentando prodotti di questo tipo. A supporto dell’utilità e dai vantaggi dati da queste acque e integratori arricchiti con idrolizzati di collagene, possiamo trovare diversi articoli (articoli nelle referenze).

Prima di iniziare, è importante far notare che spesso, questi esperimenti sono fatti da università in collaborazione con aziende (a voi il beneficio del dubbio sull’interpretazione dei dati nel titolo). Nell’articolo proposto, si studia come un’integrazione orale di peptidi specifici di collagene abbia effetti benefici sulla pelle umana. Lo studio è stato fatto in doppio cieco, ovvero senza sapere chi tra i soggetti abbia ricevuto il placebo e chi l’integratore di collagene. Il gruppo di studio in questo caso era abbastanza ridotto, in quanto rappresentato da 69 donne (dai 35 ai 55 anni) diviso in 3 gruppi di trattamento. Per ogni gruppo di trattamento 1/3 riceveva placebo, 1/3 collagene marino e l’ultimo terzo idem ma di origine animale.
I parametri osservati erano tre:
- elasticità della pelle
- idratazione della pelle
- rugosità della pelle
Analizzando i risultati si può notare come i miglioramenti siano mediocri:
- 7% per quanto riguarda l’elasticità
- 11%-14% per l’idratazione
- una riduzione del 6%-7% della rugosità
A questo punto, potremmo dire che c’è un miglioramento, anche se non statisticamente rilevante (ovvero che potrebbe esser dovuto al caso) e che non ci siano stati effetti avversi. Allo stesso tempo però, evidenziamo come nell’esperimento ci sia un “trucco”. Solitamente il placebo dovrebbe essere consono allo studio che si sta effettuando. Se si vuole testare un nuovo farmaco, per il mal di testa ad esempio, perché si cerca un prodotto migliore di uno già esistente, è rilevante fare il confronto con il vecchio prodotto. Ciò perché se voglio introdurre sul mercato un nuovo prodotto, ad esempio contro il mal di testa, devo dimostrare che sia migliore o non inferiore ai prodotti già presenti. Il fatto che il nuovo farmaco abbia effetto rispetto ad un placebo di “nulla” lo si da per scontano, o non partirebbe proprio la sperimentazione.
In questo esperimento il placebo utilizzato conteneva essenzialmente carboidrati, mentre il prodotto da testare era collagene, ovvero proteine. Ciò fa cadere la credibilità dell’efficacia dell’integratore. I miglioramenti dei parametri per la pelle potrebbero esser frutto della dieta arricchita in proteine e non al collagene in sé.
Fonte
- Zebrafish Collagen Type I: Molecular and Biochemical Characterization of the Major Structural Protein in Bone and Skin.
Pubmed - Marine Collagen Peptides from the Skin of Nile Tilapia (Oreochromis niloticus): Characterization and Wound Healing Evaluation
Pubmed - Citologia, istologia e anatomia microscopica
Damiano Zaccheo – Mario Pestarino - Oral supplementation of specific collagen peptides has beneficial effects on human skin physiology: a double-blind, placebo-controlled study.
Pubmed