I numeri quantici esprimono i valori di alcune quantità fondamentali conservate nella dinamica di un sistema, nell’ambito della meccanica quantistica. I numeri quantici vengono utilizzati per descrivere la struttura elettronica di un atomo e per quantificare le proprietà più importanti di una particella.
IN BREVE
Indice
I numeri quantici descrivono i valori delle quantità conservate nella dinamica di un sistema quantistico. Nel caso degli elettroni, i numeri quantici possono essere definiti come gli insiemi di valori numerici che danno soluzioni accettabili all’equazione d’onda di Schroedinger per l’atomo di idrogeno. Nei casi più generali, i numeri quantici corrispondono agli autovalori degli operatori che commutano con l’Hamiltoniano: quantità che possono essere conosciute con precisione arbitraria contemporaneamente. L’insieme di tutti i numeri quantici di un sistema quantistico caratterizza completamente uno stato di base del sistema. In linea di principio tutti i numeri quantici che caratterizzano un sistema possono essere misurati contemporaneamente.
LA QUANTIZZAZIONE IN MECCANICA QUANTISTICA
Un aspetto importante della meccanica quantistica è la quantizzazione di molte quantità osservabili di interesse. In particolare, questo porta a numeri quantici che prendono valori in insiemi discreti di interi o seminteri. Questo distingue la Meccanica Quantistica dalla Meccanica Classica in cui i valori che caratterizzano il sistema come massa, carica o momento, variano con continuità. I numeri quantici spesso descrivono specificamente i livelli di energia degli elettroni negli atomi, ma anche il momento angolare: lo spin. Una famiglia importante sono i numeri quantici di sapore: numeri interni a tutte le particelle (anche alle particelle subatomiche) che ne determinano il tipo e le sue interazioni con altre particelle attraverso le forze fondamentali. Qualsiasi sistema quantistico può avere uno o più numeri quantici.
I NUMERI QUANTICI DI UN ELETTRONE
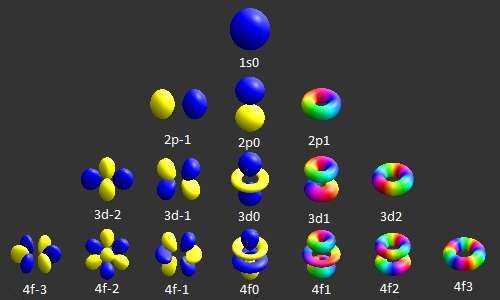
Il modello atomico di Bohr era un modello monodimensionale molto semplice, che utilizzava un solo numero quantico per descrivere la distribuzione degli elettroni nell’atomo. L’unica informazione importante era la dimensione dell’orbita, che era descritta dal cosiddetto numero quantico principale. Il più elaborato e preciso modello di Schroedinger posizionava l’elettrone in uno spazio tridimensionale. Pertanto, in questo modello sono necessarie tre coordinate, o tre numeri quantici, per descrivere gli orbitali in cui si possono trovare gli elettroni. Le tre coordinate che provengono dalle equazioni d’onda di Schroedinger sono i numeri quantici principale (n), secondario o angolare (l) e magnetico (ml). Questi numeri descrivono le dimensioni, la forma e l’orientamento nello spazio degli orbitali su un atomo. Per descrivere completamente l’elettrone al modello di Schroedinger mancava un’informazione: il momento angolare o spin. Quindi si è reso necessario anche un quarto numero quantico: il numero quantico di spin (ms). Riassumendo sono necessari quattro numeri quantici per descrivere completamente un elettrone in un atomo:
- Numero quantico principale (n)
- Numero quantico secondario (l)
- Il numero quantico magnetico (ml)
- Numero quantico di spin (ms)
L’interazione spin-orbitale, tuttavia, mette in relazione questi numeri. Così, una descrizione completa del sistema può essere data con meno numeri quantici, se vengono fatte scelte ortogonali per questi vettori di base.
Il numero quantico principale n
Il numero quantico principale descrive il livello di energia, noto anche come guscio, di un elettrone. Il valore di n è intero e varia da 1 al guscio contenente l’elettrone più esterno di quell’atomo, cioè
\(\)\[
n= 1, 2, ….
\]\(\)
Ad esempio, nel cesio (Cs), l’elettrone di valenza più esterno è nel guscio con livello di energia 6, quindi un elettrone nel cesio può avere un valore n da 1 a 6. Per le particelle in un potenziale indipendente dal tempo, il numero quantico principale rappresenta anche l’autovalore n-esimo dell’Hamiltoniano (H), cioè l’energia. Questo numero dipende solo dalla distanza tra l’elettrone e il nucleo (cioè la coordinata radiale, r). La distanza media aumenta con n, e quindi si dice che gli stati quantistici con diversi numeri quantici principali appartengano a gusci diversi.

Il numero quantico secondario l
Il numero quantico secondario, conosciuto anche come numero quantico orbitale, azimutale o angolare, descrive il sottoguscio e fornisce la grandezza del momento angolare orbitale attraverso la relazione:
\(\)\[
L^2 = h^2*l*(l+1)
\]\(\)
In chimica e spettroscopia, l=0 è chiamato orbitale s, l=1 è l’orbitale p, l=2 è noto come orbitale d e l=3 rappresenta l’orbitale f. Il valore di l varia da 0 a n -1, quindi il primo orbitale p (l=1) appare nel secondo guscio dell’elettrone (n=2), il primo orbitale d (l=2) appare nel terzo guscio (n=3) e così via:
\(\)\[
l=0, 1, 2, …, n-1
\]\(\)
Ad esempio, un numero quantico che inizia con n=3 ed l=0 descrive un elettrone nell’orbitale s del terzo guscio elettronico di un atomo. Questo è il più importante dei numeri quantici in chimica, poiché specifica la forma di un orbitale atomico e influenza fortemente i legami chimici e gli angoli di legame.
Il numero quantico magnetico m o ml
Il numero quantico magnetico descrive l’orbitale specifico (o “nuvola”) all’interno di un sottoguscio e produce la proiezione del momento angolare orbitale lungo un asse specificato:
\(\)\[
L_z = m_l*h
\]\(\)
I valori di ml vanno da -l a l, con intervalli interi. Il sottoguscio s (l=0) contiene un solo orbitale, e quindi il numero quantico magnetico ml di un elettrone in un orbitale s sarà sempre 0. Proseguendo, il sottoguscio p (l=1) contiene tre orbitali (in alcuni sistemi essi sono raffigurati come tre nubi a forma di manubrio), quindi il numero ml di un elettrone in un orbitale p sarà di -1, 0 o 1. Il sottoguscio d (l=2) contiene cinque orbitali, quindi ml può assumere i valori -2, -1, 0, 1, 2.

Il numero quantico di spin ms
Il numero quantico di spin descrive il momento angolare, noto anche come spin, dell’elettrone all’interno di un orbitale, e dà la proiezione dello spin lungo l’asse specificato:
\(\)\[
S_z = m_s*h
\]\(\)
In generale, i valori di ms vanno da -s a s, dove s è il numero quantico di spin, una proprietà intrinseca delle particelle:
\(\)\[
m_s = -s, -s+1, -s+2, …, s-2, s-1, s
\]\(\)
Un elettrone ha numero di spin s=1/2, di conseguenza ms può essere più o meno 1/2, riferendosi ai cosiddetti stati “spin up” e “spin down”. Ogni elettrone in ogni singolo orbitale deve avere numeri quantici diversi a causa del principio di esclusione di Pauli, quindi un orbitale non contiene mai più di due elettroni, corrispondenti ai numeri quantici di spin +1/2 e -1/2.
Fonte
- Quantum numbers and electron configurations
Chemed









