La chimica quantistica ha come scopo l’interpretazione dei fenomeni chimici attraverso l’utilizzo della meccanica quantistica. Quali enigmi sulla materia è riuscita a rivelare? Potrà aiutarci a sconfiggere le malattie?
IN BREVE
Indice
CHIMICA QUANTISTICA: COS’È?
La chimica quantistica è quella branca della chimica teorica che ha come scopo l’interpretazione dei fenomeni chimici attraverso l’utilizzo della meccanica quantistica. Essa è, dunque, uno strumento molto potente per studiare le proprietà delle molecole e delle loro reazioni. Per comprendere la materia al suo livello più fondamentale, dobbiamo, infatti, usare modelli e metodi meccanici quantistici. Ci sono due aspetti della meccanica quantistica che la rendono diversa dai precedenti modelli di materia. Il primo è il concetto di dualità onda-particella. Rappresenta l’idea che abbiamo bisogno di pensare a oggetti molto piccoli (come gli elettroni) come aventi caratteristiche sia di particelle che di onde. In secondo luogo, i modelli quantistici affermano che l’energia degli atomi e delle molecole è sempre quantizzata (formata da quanti), il che significa che si possono avere solo quantità specifiche di energia. Le teorie chimiche quantistiche ci permettono di spiegare la struttura della tavola periodica ed i calcoli chimici quantistici consentono di prevedere con precisione le strutture delle molecole ed il loro comportamento spettroscopico.

La nascita della chimica quantistica
Le idee della meccanica quantistica (chiamata così perché si supponeva che ci doveva essere una qualche legge meccanica coinvolta nel movimento delle particelle atomiche e dei quanti di energia simile a quella che descrive la meccanica dei corpi macroscopici, come i pianeti) iniziarono con gli studi sulla fisica della luce come tentativo degli scienziati di spiegare vari enigmi che, nella fisica di inizio Novecento, apparivano separati fra loro. Questi enigmi riguardavano, in particolare, la natura della luce emessa da corpi riscaldati a temperature diverse, la struttura interna dell’atomo e l’interazione fra luce e materia. Alla fine del XIX secolo, praticamente tutti gli scienziati credevano che la luce si comportasse come un’onda. Anche se alcuni studiosi antecedenti, come Isaac Newton nel XVII secolo, avevano pensato alla luce come costituita da particelle, gli esperimenti di Thomas Young e Augustin Fresnel all’inizio del XIX secolo dimostrarono che la luce ha proprietà ondulatorie. In questi esperimenti, la luce veniva fatta passare attraverso una coppia di fessure in uno schermo e produceva regioni alternate di luce e buio (modelli di interferenza) su un secondo schermo. Questo fenomeno, noto come diffrazione, non può essere spiegato usando un modello di particelle per la luce. Alla fine del diciannovesimo secolo, James Clerk Maxwell derivò una serie di equazioni basate sul modello ondulatorio della luce che spiegava splendidamente la maggior parte dei risultati sperimentali ottenuti in precedenza. Tuttavia, le regole del gioco erano destinate a cambiare. Nonostante questa apparente certezza che la luce fosse un’onda, infatti, Max Planck ed Albert Einstein, all’inizio del ventesimo secolo, dimostrarono che alcuni esperimenti richiedevano l’uso di un modello a particelle per la luce, piuttosto che un modello a onde. Poiché entrambi i modelli erano necessari per una descrizione accurata di tutte le proprietà della luce, gli scienziati oggi usano equazioni matematiche appropriate sia alle onde che alle particelle per descrivere le proprietà della luce.

DUALISMO ONDA-PARTICELLA: L’INIZIO DI UNA RIVOLUZIONE
Onde e particelle sono fondamentalmente diverse: una particella esiste in un punto particolare dello spazio, mentre un’onda continua per (talvolta) una grande distanza. Sfida l’intuizione pensare che entrambi questi modelli possano descrivere la stessa cosa. Tuttavia, una “definizione” accurata della luce richiede l’uso di entrambe le idee per poter essere tale. Gli esperimenti dell’inizio del ventesimo secolo mostrarono che l’energia negli atomi è quantizzata, cioè, un dato atomo può avere solo quantità specifiche di energia. Per l’idrogeno, il più semplice degli atomi, era stata determinata sperimentalmente una formula accurata per le energie possibili, ma era inspiegabile utilizzando qualsiasi modello particellare per l’atomo. L’immagine migliore che il modello particellare poteva dare, coerente con gli esperimenti sugli atomi, metteva l’elettrone in una sorta di “orbita” attorno al nucleo. Sfortunatamente, il modello particellare prevede che l’elettrone si scontri con il nucleo, rilasciando energia nel processo. Ovviamente c’era bisogno di un modello diverso per l’elettrone. Nel 1924 Louis de Broglie presentò una teoria per l’atomo di idrogeno che modellava l’elettrone come un’onda. I calcoli fatti per questo modello danno la quantizzazione dell’energia che si osserva sperimentalmente in questo atomo. De Broglie postulò anche una formula generale per ottenere la lunghezza d’onda di un oggetto in movimento. La sua formula, che è analoga a quella usata per la luce, afferma che la lunghezza d’onda di un oggetto in movimento è inversamente proporzionale alla sua quantità di moto (massa per la velocità). Essendo la lunghezza d’onda dell’elettrone abbastanza grande da poter essere misurata, sono stati fatti esperimenti di diffrazione con gli elettroni, dimostrando definitivamente che essi hanno proprietà ondulatorie. Un concetto sicuramente brillante e straordinario. La materia non risulta composta da particelle che percorrono traiettorie ben definite, ma ha piuttosto un comportamento analogo ad un’onda che si propaga occupando simultaneamente diverse zone dello spazio. Sorprendente, vero? Se lancio un elettrone non posso immaginare che percorra una parabola come se fosse un pallino da caccia: il suo comportamento assomiglia piuttosto a ciò che fa un’onda quando risale un fondale per raggiungere la spiaggia. È una descrizione che ancora oggi non riusciamo ad intuire pienamente. Al confronto, gli effetti speciali di Spielberg sembreranno poca cosa: la natura, in effetti, è molto più sorprendente dei film di fantascienza.

Principio di indeterminazioni di Heisenberg
Come risolvere allora il problema della posizione e della velocità dell’elettrone? È stato Heisenberg a trovare una soluzione che si è imposta all’attenzione di tutti. Nel 1925 scriveva a Pauli, suo maestro:
“Tutti i miei magri sforzi vanno nella direzione di eliminare e rimpiazzare adeguatamente il concetto di orbita che non possiamo osservare. Io credo che l’esistenza di una traiettoria nel senso classico possa essere formulata in un modo profondo dicendo: “La traiettoria diventa reale solo quando la si osserva”.
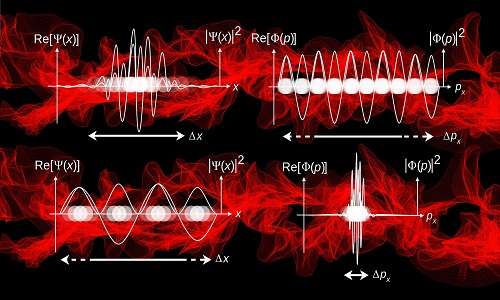
Una conseguenza della natura ondulatoria della materia è che la posizione e la quantità di moto di piccoli oggetti non sono ben note, come lo sarebbero per un modello a particelle. In alcune circostanze, un’onda può essere confinata in una regione molto stretta nello spazio; tuttavia, c’è ancora una certa incertezza sulla sua posizione. Inoltre, il valore della quantità di moto di un oggetto quantico spesso non è noto con precisione. Egli dimostrò che il prodotto dell’incertezza della posizione e dell’incertezza della quantità di moto è maggiore o uguale a una certa costante (la costante di Planck divisa per 4 π). Questa costante è molto piccola, di conseguenza l’incertezza meccanica quantistica nella posizione e nella quantità di moto degli oggetti che sono abbastanza grandi da essere visti non viene notata sperimentalmente. Per gli elettroni, tuttavia, le incertezze quantomeccaniche nella posizione e nella quantità di moto sono considerazioni importanti nell’interpretazione sia dei modelli teorici che dei risultati sperimentali. La relazione tra le incertezze nella posizione e nella quantità di moto è nota come principio di incertezza di Heisenberg. Ci dice che più sappiamo della posizione di un piccolo oggetto, come un elettrone, meno sappiamo della sua quantità di moto (e viceversa). Per uno scienziato, sapere che la materia assume il comportamento di un’onda è utile solo se si sa qualcosa su quell’onda. E da dove si possono dedurre queste informazioni? Proprio dalla sua funzione. Per esempio, y (x) = A sin(kx) potrebbe essere la funzione d’onda per un’onda unidimensionale, che esiste lungo l’asse x. Le onde della materia sono tridimensionali; la relativa funzione d’onda dipende dalle coordinate x, y e z del sistema studiato (e talvolta anche dal tempo). Per convenzione etichettiamo la funzione d’onda per un oggetto tridimensionale come ψ ( x, y, z ). Nel 1926 Erwin Schrödinger introdusse un’equazione matematica per cui, se si conosce l’energia potenziale che agisce su un oggetto, si può calcolare la funzione d’onda per lo stesso. Heisenberg aveva già introdotto un formalismo matematico per eseguire calcoli di meccanica quantistica, senza includere esplicitamente il concetto di onde. In seguito fu dimostrato che, sebbene gli approcci di Schrödinger e Heisenberg sembrassero molto diversi, facevano esattamente le stesse previsioni. In pratica, il formalismo di Schrödinger è più utile per spiegare il problema studiato, e la metodologia di Heisenberg permette un calcolo più semplice. Di conseguenza, una miscela dei due approcci è tipicamente usata nella chimica quantistica moderna. Una volta che conosciamo la funzione d’onda dell’atomo o della molecola sotto studio, possiamo calcolare le proprietà di quell’atomo o molecola. Una soluzione esatta per l’equazione d’onda di Schrödinger può essere ottenuta per l’atomo di idrogeno; tuttavia, per atomi e molecole più grandi (che contengono più di un elettrone), l’equazione di Schrödinger può essere risolta solo approssimativamente. Anche se questo può sembrare così restrittivo da rendere l’equazione inutile, ci sono approcci consolidati che permettono calcoli pratici e accurati su atomi e molecole. Questo viene fatto facendo alcune ipotesi su sistemi più grandi basati sull’atomo di idrogeno, come spiegato di seguito.
Cos’è un orbitale?
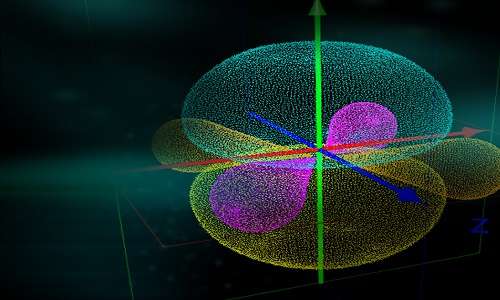
Quando l’equazione di Schrödinger è risolta per l’atomo di idrogeno, le funzioni d’onda risultanti per le varie energie possibili che l’atomo può avere sono usate per determinare gli orbitali atomici. Un orbitale è una regione nello spazio dove è più probabile che si trovi un elettrone. Per esempio, la funzione d’onda a più bassa energia per un atomo di idrogeno è il cosiddetto orbitale 1s, che è una regione sferica nello spazio che circonda il nucleo. Per alcuni stati a più alta energia, gli orbitali non sono necessariamente di forma sferica (per esempio, l’orbitale 2p, un orbitale di forma ovale in ciascuna delle tre dimensioni spaziali, ognuna contenente al massimo 2 elettroni). Per gli atomi più grandi dell’idrogeno, si suppone che gli orbitali occupati dagli elettroni abbiano la stessa forma degli orbitali dell’idrogeno, ma siano diversi per dimensione ed energia. Le energie corrispondenti a questi orbitali possono essere trovate risolvendo una versione approssimata dell’equazione di Schrödinger. Questi orbitali atomici, a loro volta, possono essere usati come elementi costitutivi del comportamento elettronico nelle molecole, come vedremo più avanti. Succede che due elettroni possono condividere un orbitale atomico; diciamo che questi elettroni sono accoppiati. I chimici hanno sviluppato un sistema di regole per determinare quali orbitali sono occupati in quali atomi; si possono poi fare calcoli per determinare le energie degli elettroni negli atomi. Per gli atomi più grandi dell’idrogeno, si suppone che gli orbitali occupati dagli elettroni abbiano la stessa forma degli orbitali dell’idrogeno, ma siano diversi per dimensione ed energia. Le energie corrispondenti a questi orbitali possono essere trovate risolvendo una versione approssimata dell’equazione di Schrödinger. Questi orbitali atomici, a loro volta, possono essere usati come elementi costitutivi del comportamento elettronico nelle molecole. Succede che due elettroni possono condividere un orbitale atomico; diciamo che questi elettroni sono accoppiati. I chimici hanno sviluppato un sistema di regole per determinare quali orbitali sono occupati in quali atomi; i calcoli possono poi essere fatti per determinare le energie degli elettroni negli atomi.
LE APPLICAZIONI DELLA CHIMICA QUANTISTICA: I QUANTUM DOTS
I processi biologici nell’organismo si verificano tramite una dinamica composta da meccanismi chimici, da eventi molecolari che si susseguono in modo ordinato nel tempo e nello spazio. Le biomolecole non interagiscono a caso ma secondo pattern ben definiti attraverso cui si scambiano messaggi elettromagnetici con precisi effetti biologici. Dunque, è intuitivo pensare che la chimica quantistica possa trovare applicazione anche nel campo medico. In particolare, i quantum dots, punti quantici o qdots, sono particelle di materiali semiconduttori, di solito metalli pesanti, che, grazie alle dimensioni nanometriche, sfruttano il comportamento quantistico per dar luogo a particolari processi di assorbimento ed emissione della luce. Essi possono trovare vari tipi di applicazione grazie a proprietà nettamente diverse rispetto alle normali sostanze. Come dice il nome, infatti, le dimensioni estremamente piccole (tipicamente nel range di 1-10 nm) permettono di sfruttare le proprietà quantistiche di questi nanomateriali, che vengono invece perse quando si ha a che fare con quantità più elevate, per quanto su scala microscopica, di materia. Per quanto riguarda le loro possibili applicazioni in campo biomedico, il problema delle nanotecnologie è sempre quello di fare i conti con i sistemi fisiologici, specialmente quando le nanoparticelle contengono sostanze difficilmente biocompatibili come in questo caso. A livello diagnostico, i quantum dots hanno già trovato largo impiego come biosensori, grazie alla sensibilità di risposta del segnale. Essi sono stati sfruttati, specialmente negli ultimi anni, nel campo dell’imaging. Andando a funzionalizzare la particella quantica con opportuni leganti diretti verso un particolare target, siano essi una proteina o un organello all’interno della cellula, si ottiene un’immagine di fluorescenza estremamente più vivace e intensa di quella che si potrebbe avere con qualunque altra sonda fluorescente. Qdots permettono anche la messa a punto di sofisticate strategie di binding assays per identificare interazioni specifiche a livello cellulare. Tra questi, una particolare rilevanza trova la tecnica di Förster resonance energy transfer (Fret), noto strumento della biofisica. Questa tecnica viene usata per indagare le caratteristiche strutturali delle proteine, ad esempio se due residui proteici sono vicini tra loro. Avvicinando un quantum dot, carico di energia fluorescente, ad un altro oggetto ad una piccolissima distanza (1 o 2 nm) l’energia accumulata nella coppia elettrone-buca viene trasferita a quest’ultimo. A cosa serve questa energia? Essa è spesso sufficiente a distruggere legami chimici, come ad esempio i ponti disolfuro in una proteina, o comunque a causare un danno specifico. Ne consegue che con una sonda Fret si possano vedere cose che sarebbe impossibile osservare al microscopio elettronico. Dunque si può arrivare, per esempio, alla mappatura di una struttura. Altri possibili impieghi dei punti quantici includono la generazione di colori diversi nella bioanalisi in multiplex, e l’uso in test immunologici, di rilevazione di acidi nucleici o di marcatura e analisi cellulare. In alcuni studi è stato possibile evidenziare loci genomici provirali singoli di sequenze del virus Hiv all’interno dei cromosomi nel nucleo di cellule vive, grazie ad una tecnica di imaging che ha utilizzato quantum dots in parallelo a effettori “activator-like” della trascrizione (TALEs).

E le applicazioni farmaceutiche? In letteratura sono riportati diversi esempi dell’utilizzo dei quantum dots in medicina e mirati tutti allo sviluppo di strategie di drug targeting in cui i punti quantici possono venire utilizzati alla stregua di nanovettori per veicolare farmaci, geni o vaccini. Un singolo qdot può anche legare molecole diverse, e potrebbe ottimizzare così veicolazione delle cosiddette “multi target therapies”, ovvero accoppiando al farmaco una molecola diagnostica che permetta di monitorarne il rilascio e l’assorbimento al sito desiderato. Inoltre si è pensato di rendere i qdots potenziali “bombe” per la distruzione delle cellule tumorali, raggiungendo un sito bersaglio e rilasciando lì una notevole quantità di energia. Tuttavia, il principale ostacolo rispetto alle possibili applicazioni farmacologiche è che i qdots più comuni sono quasi tutti a base di metalli pesanti. L’esempio tipico è quello del selenuro di cadmio. La tossicità dei metalli pesanti sui vari organi, infatti, è infatti nota e quindi ne limita l’utilizzo. Nonostante gli inconvenienti appena citati, diversi sono i gruppi di ricerca attivi per cercare di sviluppare nuovi sistemi tecnologici per la realizzazione di quantum dots con materiali biocompatibili. Anche se la strada è ancora lunga, questa potrebbe essere la chiave di volta per la creazione di nuove terapie estremamente efficaci e che affondano le loro radici nelle conoscenze delle brillanti menti degli scienziati del diciannovesimo secolo che, con le loro intuizioni, hanno portato a ciò che poteva definirsi solo “fantascienza”.
Fonte
- Quantum chemistry
Elsevier Academic Press - Quantum dots in biomedical applications
Acta Biomaterialia









